ANZINE : CAE 기술 매거진
이전 ANZINE Home Tech-Insight
Chemkin-Pro의 반응 경로 분석기를 이용한 운전조건 최적화
- 염기환 매니저
- 태성에스엔이
- ghyeom@tsne.co.kr
Chemkin-Pro의 반응 경로 분석기를 이용한 운전조건 최적화
Introduction
Ansys Chemkin-Pro는 많은 화학종과 상세화학반응 메커니즘을 이용하여 다양한 조건과 반응기 종류에 따라 정확하고 빠르게 반응유동을 해석할 수 있는 프로그램이다. Chemkin-Pro의 후처리 기능 중 하나인 반응 경로 분석기 (Reaction Patch Analyzer)는 대상 화학종이 생성되는 경로와 소모되는 경로를 그래픽으로 나타내며, 사용자는 이 결과를 바탕으로 반응메커니즘에 대한 이해와 통찰력을 높일 수 있다.
본 글에서는 반응 경로 분석기 기능에 대해 알아보고, 암모니아 혼합연료 연소과정에서 질소산화물의 발생량을 줄일 수 있는 첨가물을 찾고, 첨가물의 유입 비율에 따른 결과를 확인해 본다.
반응 경로 분석기(Reaction Path Analyzer)
Chemkin-Pro에서 반응해석을 위한 입력 파일(반응 메커니즘, 열역학적 물성 등)을 불러와 대상 공정에 맞는 반응기를 선택하고 운전 조건을 입력해야 반응 경로 분석기를 사용할 수 있다. 반응 경로 분석기 실행 창은 그림 1과 같다.
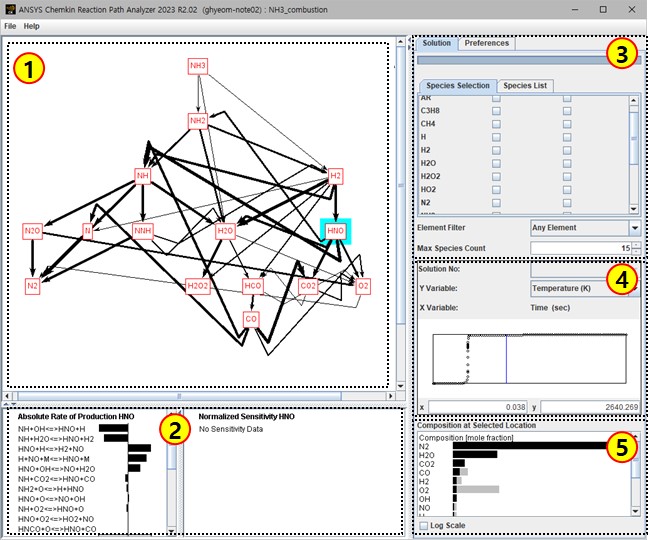
그림 1. 반응 경로 분석기 화면
그림 1의 ①영역에서 화학종의 생성 경로를 확인할 수 있다. 검은색 화살표 또는 붉은색으로 나타난 화학종을 선택하면 ②영역에서 해당 경로 또는 화학종이 참여하는 반응에 대한 정보를 확인할 수 있다. 반응 정보는 반응식, 물질의 반응/생성량, 정반응과 역반응에 대한 반응 속도, 민감도 분석 결과가 출력 된다. ③영역에서는 탭 메뉴에서 설정을 변경할 수 있으며, 현재 나타낸 그림에서는 반응 경로를 나타낼 시작 물질과 최종 물질을 선택할 수 있다. 또한 ①영역에 나타나는 화학종의 개수도 지정할 수 있다. ④영역에서는 반응 경로를 확인할 위치를 선택한다. 과도 상태(Transient) 해석을 수행한 경우 초기에서 최종 도달 시간까지의 각 사이 시간에서 반응 경로를 확인하거나 1D 반응기의 경우 길이 방향으로 각 위치에서의 반응 경로를 확인할 수 있다. 정상 상태 해석이 아닌 경우 각 위치마다 우세한 반응 경로가 달라지므로 신중하게 결과를 확인해야 한다. ⑤영역에서는 ④영역에서 선택한 위치에서 물질 간 몰 비율(Mole Fraction)을 나타낸다.
암모니아 혼합연료 연소 해석 조건
암모니아 혼합연료 연소반응을 해석하기 위한 조건은 다음과 같다.

표 1. 연소반응 해석 시 원료 조성
혼합 연료와 산화제는 500 sccm, 1,300 K로 유입되며, 당량비는 매개변수 연구를 통해 0.5에서 1.5까지 계산하여 연소 온도가 가장 높은 조건을 선택했다.
첨가제는 100 sccm으로 초기 해석에서는 비활성 가스인 아르곤 100%를 첨가했다. 그 후 반응 경로 분석을 통해 질소 산화물을 저감시킬 수 있는 물질을 탐색한 뒤, 아르곤과 함께 비율을 조절하여 첨가했다.
기준 조건의 반응 해석
연료와 산화제는 혼합된 형태로 공급되고, 첨가제는 연소 발생 후 공급하는 형태로 그림 2와 같이 Diagram을 구성했다.
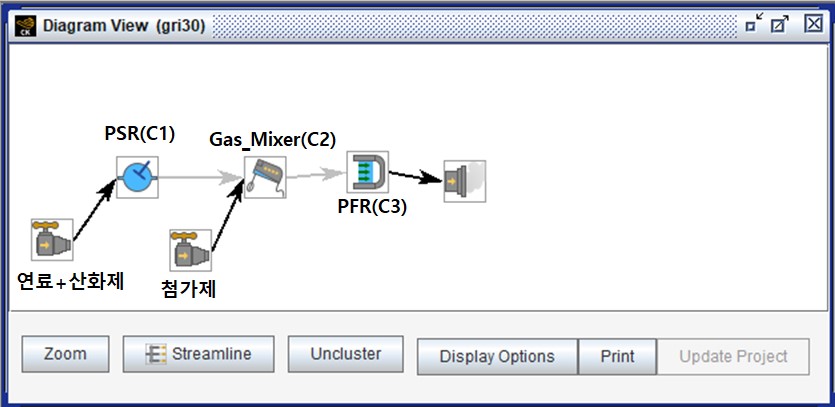
그림 2. Chemkin-Pro Diagram 구성
연소해석에 사용할 반응 메커니즘으로는 GRI Mech 3.0을 사용했다. GRI Mech 3.0은 총 53개의 화학종과 325개의 반응 메커니즘으로 구성되어 있다.
그리고 반응기 모델 설정으로는 최적의 연소효율을 찾기 위해 연료와 산화제의 비율(당량비, Equivalence Ratio)을 그림 3과 같이 매개변수로 지정해, 당량비가 0.5 ~ 1.5일 때 단열화염 온도를 측정했다.
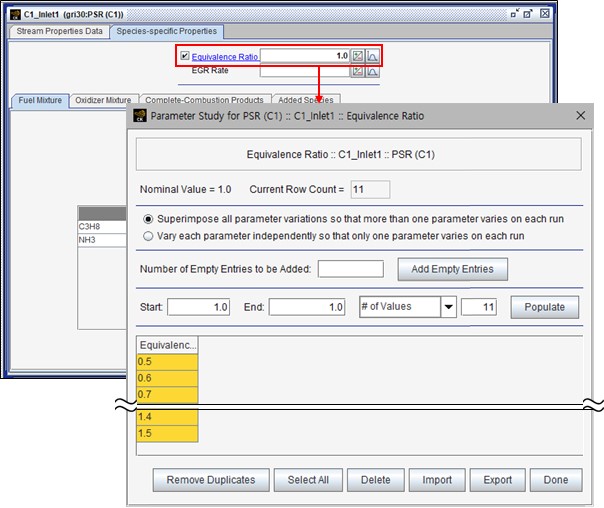
그림 3. 당량비의 매개변수 설정
그 외에 각 반응기의 운전조건과 첨가제 공급에 대한 Inlet 설정을 하고 계산을 수행한다.
총 11개의 Case가 1분 내외로 완료되면 그림 4와같이 Analyze Results 창이 나타난다.
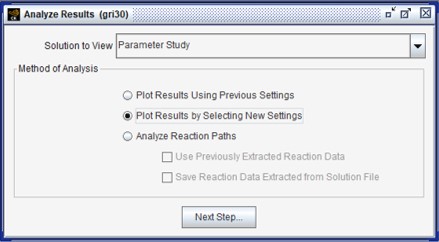
그림 4. Analyze Results 화면
Analyze Results 창에서 2번째 옵션인 “Plot Results by Selecting New Settings”를 선택하고 다음 창에서 기본 설정을 유지한 상태에서 “Progress Solution Data” 버튼을 누르면 그림 5와 같이 Ansys Chemkin Visualizer가 나타난다.
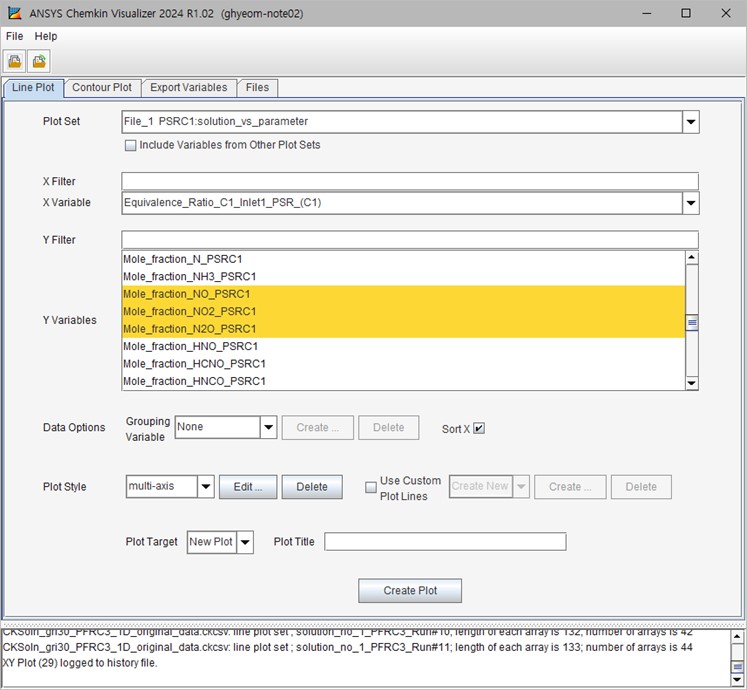
그림 5. Chemkin Visualizer 화면
Ansys Chemkin Visualizer에서는 X축과 Y축 변수를 선택하여 그래프 형태로 결과를 나타낼 수 있다. 그림 6은 당량비에 따른 연소온도와 질소산화물의 몰 비율을 나타낸 결과이다.
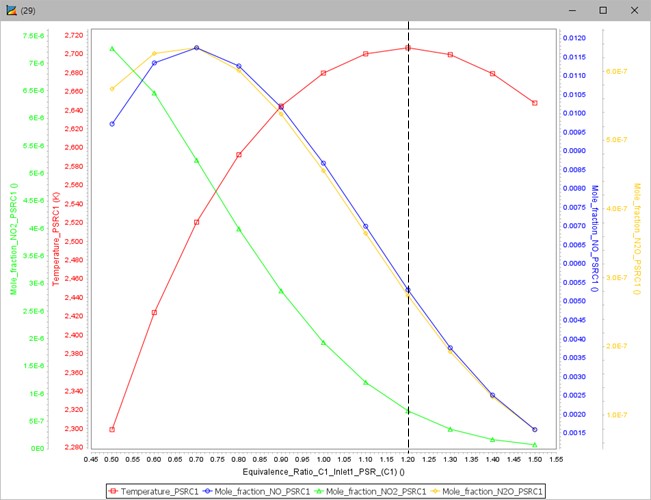
그림 6. 당량비에 따른 온도, 몰 분율 그래프
암모니아 혼합연료 연소 시 당량비가 1.2일 때 단열화염온도가 약 2,700K으로 가장 높은 온도를 나타내고 있다.
기준 조건의 반응경로 분석
다음으로 당량비가 1.2일 때 반응경로를 분석하였다. 반응 경로 분석기는 그림 4의 Analyze Results 창에서 “Analyze Reaction Paths”를 선택한 뒤 결과를 확인할 Case를 선택한다.
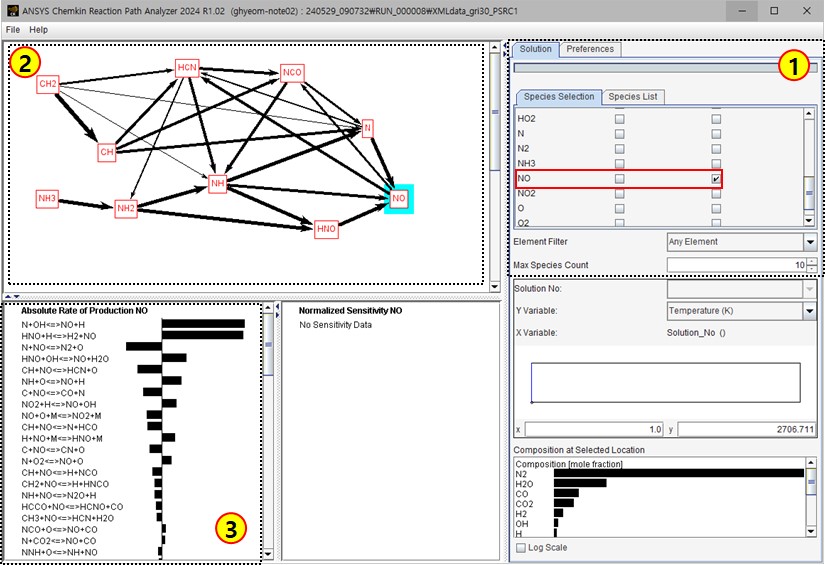
그림 7. 반응 경로 분석기 화면
반응 경로 분석기가 실행되면 그림 7과 같이 나타나며, 그림 7의 ①영역에서 최종물질로 NO를 선택하면 ②영역에서 NO가 생성되는 반응경로가 나타난다. 그리고 ②영역에서 화학종으로 NO를 선택하면 ③영역에서 NO가 반응물과 생성물로 사용되는 반응식 목록과 각 반응에 의한 NO의 생성 속도가 막대그래프로 나타난다.
②영역에서 화학종이 아닌 화살표로 표시된 반응경로를 선택하면 그림 8과 같이 물질이 변환되는 반응과 반응속도에 대한 정보를 확인할 수 있다.
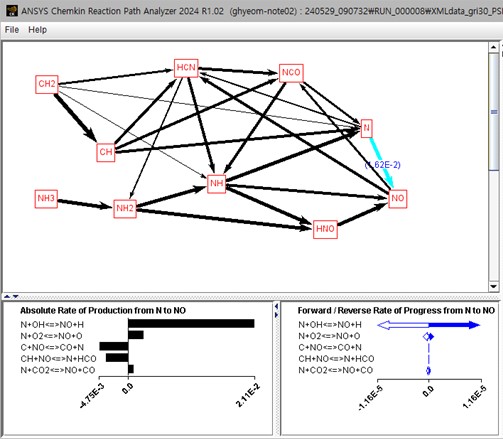
그림 8. N→NO로 전환되는 반응 확인
본 해석에서 NO의 농도를 낮추기 위해서는 그림 7의 ③영역에 NO 생성에 두번째로 높게 기여하는 HNO+H <=> H2+NO 반응에서 수소(H2)의 농도를 높여 역반응을 촉진하는 방법을 고려했다.
질소산화물 저감 해석 – 수소 첨가
반응 경로 분석을 통해 NO와 수소의 관계를 확인했지만, 실제로 수소를 첨가해 질소산화물의 농도가 줄어드는지 확인이 필요하다. 이 가정에 대한 결과를 확인하기 위해 Chemkin-Pro에서 첨가제로 공급되는 아르곤 Inlet에 수소를 추가하고, 수소의 몰 분율을 증가시켜가며 해석을 수행했다. 그림 9는 첨가제 Inlet에 수소를 추가하고, 수소의 비율을 매개변수로 설정하는 화면을 나타낸다.
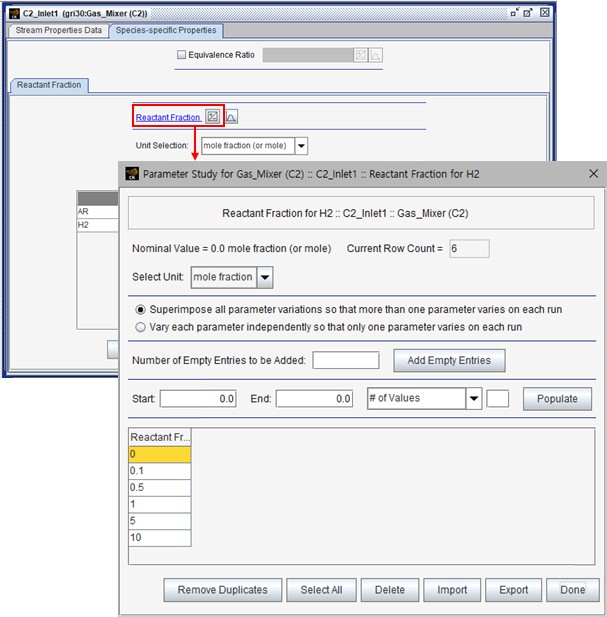
그림 9. 첨가되는 수소의 매개변수 지정
Inlet에서 설정된 몰 분율의 합이 1을 넘어가는 경우 자동으로 Normalization이 진행되면서 합이 1이 되도록 아르곤과 수소의 몰 분율 값이 보정된다.
기준 조건에서 당량비에 대한 매개변수 설정은 제거한 상태에서, 첨가제로 수소의 몰 분율만 매개변수로 지정한 뒤에 계산을 진행한다.
그림 10은 수소 농도에 따른 질소산화물의 농도 변화 그래프이며, 그림 11은 수소농도에 따른 온도 그래프이다.
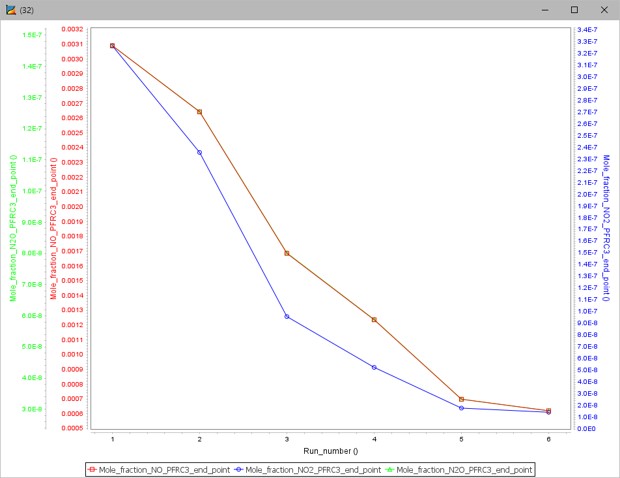
그림 10. 수소 첨가 시 질소산화물 몰 분율 그래프
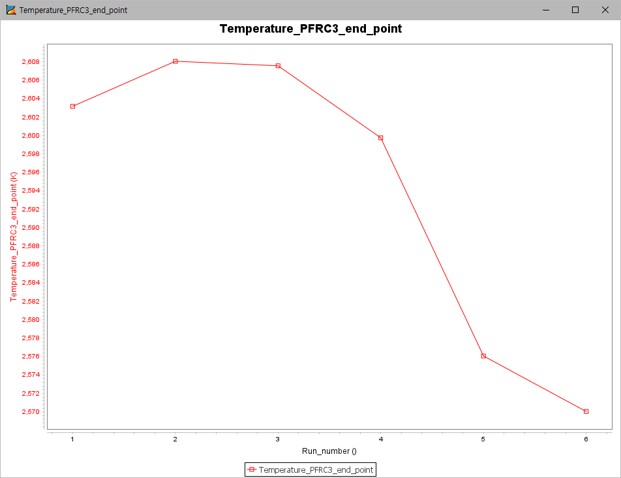
그림 11. 수소 첨가 시 온도 변화 그래프
그림 10은 첨가제에서 수소의 몰 분율이 높아질수록 질소산화물의 농도가 낮아지는 결과를 나타낸다. 하지만 그림 11을 보면 2번, 3번 Case까지는 기존 조건보다 온도가 높지만 4번~6번 Case 이후로는 온도가 낮아진다.
두 결과로 보아 수소 첨가는 1번~3번 Case 조건인 0~33% 몰 농도가 적합할 것으로 판단된다.
부가적으로, 그림 7의 ③영역에서 NO의 생성에 기여도가 가장 높은 반응에서는 수소(H2) 대신 NO와 수소 원자(H)가 생성된다.
현실에서는 수소 원자를 첨가제로 공급하는 것이 거의 불가능 하지만 해석상으로는 간단하게 수소 원자를 첨가할 수 있다.
그림 12와 그림 13은 첨가제로 수소 대신 수소 원자(H)를 공급했을 때 질소산화물의 몰 분율과 온도 그래프를 나타낸다.
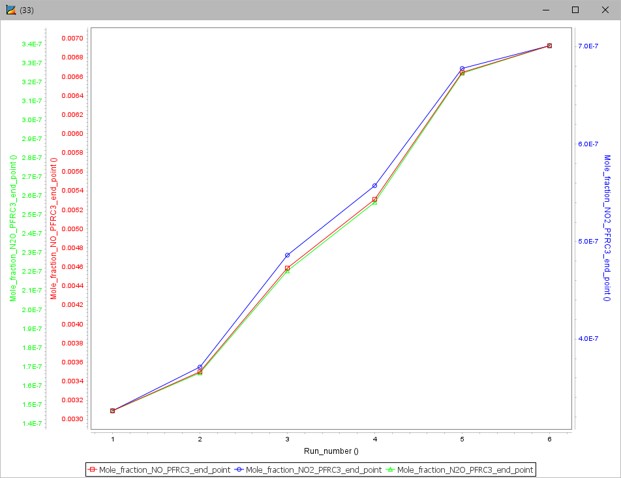
그림 12. 수소 원자 첨가 시 질소산화물 몰 분율 그래프
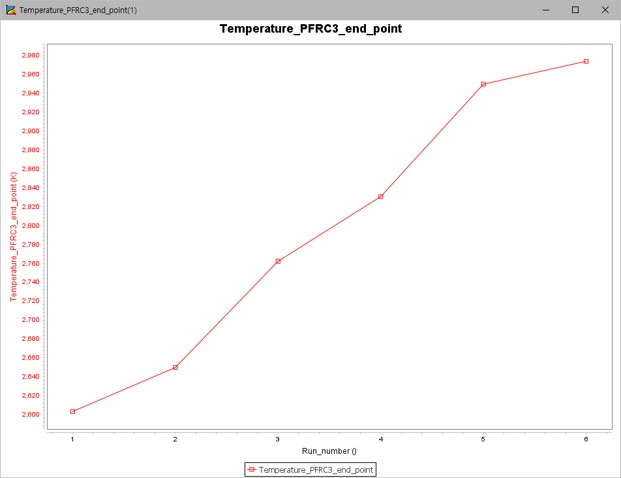
그림 13. 수소 원자 첨가 시 온도 그래프
이 경우에는 첨가제로써 수소 원자의 몰 분율이 증가할수록 질소산화물과 온도가 모두 상승하는 것을 확인할 수 있다. 수소 원자가 공급되면 중간의 다른 물질들과 반응하여 오히려 질소산화물의 몰 분율이 증가하는 방향으로 메커니즘이 작동하는 것으로 판단된다.
맺음말
이번 호에서는 Chemkin-Pro의 반응 경로 분석기를 통해 암모니아 혼합연소 공정에서 질소산화물의 발생량을 저감할 수 있는 첨가 물질을 탐색하고, 첨가 물질의 추가로 인한 영향을 확인해 보는 과정에 대해서 살펴보았다. 어느 정도 반응에 대한 지식이 있다면 반응 경로 분석기를 통해 대상 공정의 반응 메커니즘을 쉽게 분석하여 공정 효율을 증가시키거나 부산물을 저감하는 방법에 대해 고안할 수 있다. 그리고 고안된 조건은 다시 Chemkin-Pro에서 매개변수연구를 통해 변경된 조건에 대한 반응해석 결과를 빠르게 확인해 볼 수 있다.








 ㈜태성에스엔이
㈜태성에스엔이


